Tout dent titane (2)
Nous avons vu dans l’article précédent la formation et la composition de la plaque dentaire. Maintenant, nous nous pencherons sur le titane et, plus précisément, le dioxyde de titane. Pour rappel, le titane a été découvert par William Gregor (Angleterre) en 1791. Son étymologie vient de Titans, fils de la Terre et du ciel, dans la mythologie grecque (rien que ça !).
D’aspect brillant et gris foncé, il brûle dans l’air sous forme de poudre. Il peut être poli très fortement et il ne se ternit pratiquement pas. Il ne réagit pas avec les bases et la plupart des acides. Du fait que le titane est dur et qu’il résiste aux acides, il est utilisé dans de nombreux alliages. L’oxyde de titane (TiO2), pigment blanc qui couvre très bien une surface, est utilisé entre autre, pour la peinture, le caoutchouc et le papier. Le prix du titane pur à 99.95 %, sous forme de mousse, est de 203 € / kg.

[Source image : lien cassé]
Oui, c’est fini le baratin de présentation, désolé, j’ai pas pu m’en empêcher d’en ajouter une couche brillante. Nous allons nous intéresser au processus de la photocatalyse. C’est quoi ça encore ? Baisse tes yeux à la ligne suivante et tu auras la réponse à ta question.
La photocatalyse
La photocatalyse est un phénomène naturel dans lequel la lumière agit sur une substance appelée photocatalyseur et qui accélère la vitesse d’une réaction chimique. Dans ce type de réaction le catalyseur n’est ni consommé ni altéré. Ici, nous avons donc besoin de deux composants :
- De la lumière sous forme de rayons ultra-violets (UV).
- Un catalyseur, le dioxyde de titane (TiO2)
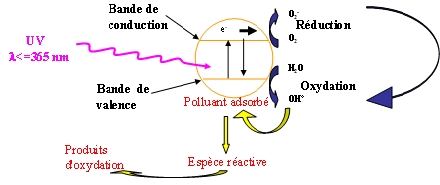
[Source image : lien cassé]
Sans entrer dans les mécanismes d’une réaction chimique pour les profanes, sachez simplement que le dioxyde de titane réagit à la lumière et créé une paire d’électrons-trous et donc des électrons libres qui se combinent avec l’eau pour donner des radicaux libre (HO) suivant la formule suivante :
TiO2 + 2H2O = Ti + 4HO.
Ces radicaux libres (ou oxydants ou encore formes actives de l’oxygène) s’attaquent ensuite aux polluants, ici les ions hydrogènes de la plaque dentaire. Cependant, ils peuvent aussi s’attaquer aux parois des cellules. En temps normal, notre organisme produit des anti-oxydants (des enzymes en fait), présentes dans la cellule, qui limitent et réparent les dégâts. Malheureusement, elles ne peuvent pas neutraliser tous les radicaux libres libérés par le TiO2 à cause de leur quantité. Pire : lorsque les cellules de l’organisme sont oxydées par des radicaux libres primaires (HO), il se forme des radicaux libres secondaires (ROO-) qui sont beaucoup plus dangereux. Ils sont capables de réactions d’oxydation en chaînes qui conduisent à la destruction des cellules, d’où l’apparition éventuelle de nombreuses pathologies.
Conclusion : la brosse à dent en titane, arnaque ou vérité ?
Ici, encore une fois, l’argument semble bon : la plaque dentaire, qui est acide, se désagrège sous l’action des oxydants ou radicaux libres produits par le dioxyde de titane sous l’effet de la lumière. Cependant, je soulève des remarques :
1) La photocatalyse ne se produit que lorsque le TiO2 est soumis aux rayons UV. Il n’est pas fait mention des autres rayons lumineux (infra-rouges, lumière visible…) pendant ma documentation. Donc comment savoir si le TiO2 produit bien les ions négatifs juste avec la lumière artificielle, sachant que beaucoup de salles de bain n’ont pas de fenêtre ? Et encore, en présence de fenêtre, il faudrait que la lumière naturelle qui entre soit assez riche en rayons UV qui tombent pile sur la brosse à dent.
2) Quid de la production des oxydants susceptibles d’attaquer les cellules de la cavité buccale et comment savoir leur quantité produite par la réaction entre le TiO2 et la lumière ?
3) Il semblerait que le dioxyde de titane, sous forme de poudre ou de nanoparticules, serait cancérigène. Je n’ai pas trouvé d’indications sur la forme solide du TiO2.
4) Prenons finalement le cas où la photocatalyse marche bien, quelle que soit la source lumineuse, que les ions négatifs sont libérés en quantité raisonnable, que le TiO2 n’est pas toxique, j’avoue que je n’y crois pas trop au concept. Pourquoi ? Pour la bonne raison que je me vois mal me déboîter la mâchoire pour m’enfiler la brosse à dent jusque dans la gorge pour être sûr de bien irradier toutes mes dents, mêmes celles du fond, des ions négatifs. Bin vi, le dioxyde de titane n’est pas dans la tête de la brosse à dents mais dans la tige de la tête et ça fait une sacré différence pour moi…
Je peux me tromper mais ça me semble être une arnaque, plus ou moins : concept révolutionnaire, étude scientifique à l’appui, prix assez élevé, arguments surfant sur l’écologie et l’exotisme (vient du Japon), mouais… Je préfère encore ma bonne vieille méthode : me brosser les dents d’une façon mécanique, régulièrement tous les jours et surveiller ma consommation alimentaire. Ça, c’est écolo et pas cher !
En savoir plus…
– Le dioxyde de titane : une nanomolécule mise à l’épreuve
Dans la même catégorie
Tout dent titane (1)











Les champs marqués d'une astérisque * sont obligatoires
Envie d'une image avec ton nom ?
Alors, va sur le site Gravatar et inscris toi pour télécharger ton image. Il ne reste plus qu'à entrer la même adresse mail sur le blog que celle choisie sur Gravatar et ton avatar est affiché ! Ch'est pô beau cha ?