Pourquoi ça pique les bulles des boissons gazeuses ?
Pause repas du midi : je savoure le soleil devant un wok délicieux tout en papotant avec ma collègue. Je bois mon sprite, la sensation habituelle de picotement se déverse sur ma langue avant de s’engouffrer dans ma gorge. Et là, me vient cette question qui a fait lever les yeux au ciel de ma collègue :
Pourquoi les bulles des boissons gazeuses sont-elles piquantes ?
J’ai tout de suite pensé à la présence du dioxyde de carbone (CO2). Bingo ! Il faut savoir que le CO2 est un gaz incolore et inodore qui se dissout facilement dans l’eau (et donc dans tout liquide à base d’eau) selon la réaction de carbonatation suivante :
H2O (eau) + CO2 (dioxyde de carbone) = H2CO3 (acide carbonique)
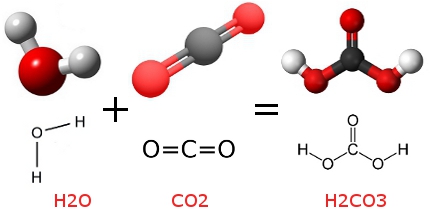
[Source images eau, dioxyde de carbone et acide carbonique]
Cette carbonatation est obtenue soit naturellement lors de la fermentation des sucres en alcool (vins pétillants, bière…), soit artificiellement par l’injection de dioxyde de carbone dans le liquide (soda, eau gazeuse…). Le résultat final de la réaction entre l’eau et le dioxyde de carbone est l’acide carbonique qui donne cette saveur particulière. Comment ? En se fixant sur des capteurs spécifiques des voies rétro-nasales selon le modèle clé-serrure (ou comme un lego). Pour faire simple, la sensation de goût résulte de l’association entre une molécule et son capteur spécifique. Cependant, cette saveur peur varier selon l’eau utilisée au départ de la fabrication. Et enfin, la sensation de piquant résulte également des micro-chocs créés par l’éclatement des bulles de gaz sur la langue et la gorge.
Quels sont les mécanismes d’emprisonnement du dioxyde de carbone (CO2) ?
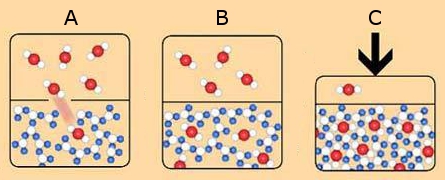
Ils varient selon la situation et le facteur concerné. Voyons ensemble trois exemples :
- A) Conditions normales : le CO2 se dissout facilement dans l’eau mais il s’échappe aussi facilement des chaînes moléculaires de l’eau qui sont « lâches ».
- B) Baisse de la température : l’activité des molécules ralentit. Les liaisons hydrogène deviennent plus forts et le CO2 ne peut plus briser les chaînes moléculaires de l’eau : le CO2 est piégé. Cependant, il reste beaucoup d’espace entre chaque molécule.
- C) Augmentation de la pression : le CO2 est entassé dans l’eau jusqu’à que le mélange soit super-saturé. Le CO2 est alors davantage dissous dans l’eau par rapport aux conditions normales : il est piégé.
Voilà pourquoi les boissons gazeuses sont mises sous pression. Le champagne, par exemple, peut contenir jusqu’à 5L de CO2 par bouteille de 0,75 L ! A l’ouverture, le gaz s’échappe d’où l’effet pétillant. Puis, les conditions dans la bouteille reviennent progressivement à la normale : les boissons gazeuses finissent par s’éventer si l’on ne les rebouche pas rapidement. Le facteur température explique l’importance de les garder au frais pour conserver la saveur piquante sinon le goût disparaît. Ce sont l’une des plusieurs propriétés de la carbonatation : apporter du goût et aussi prolonger la durée de vie de la boisson.
En savoir plus…
– Fiche sur le dioxyde de carbone
– Pourquoi l’eau gazeuse, ça pique ?
– Avantages de la carbonatation
Dans la même catégorie
A quoi sert la trompe d’Eustache ?
Caca : tout sur la couleur (7)
8 Pierrot ont pris leur plume. Et toi ?
Les champs marqués d'une astérisque * sont obligatoires
Envie d'une image avec ton nom ?
Alors, va sur le site Gravatar et inscris toi pour télécharger ton image. Il ne reste plus qu'à entrer la même adresse mail sur le blog que celle choisie sur Gravatar et ton avatar est affiché ! Ch'est pô beau cha ?











bonjour, moi je suis cadre laboratoire dans une laiterie, en fait on a un problème majeur de contamination par la levure de bière, qui cause un gonflement du produit dans les températures élevées (37°C)et dans des températures basses on a une forte acidification un goût piquant mais sans gonflement je pense que la réponse figure dans cet article!! 😀
Bonjour,
Ah, c’est marrant de voir une application dans un champ inédit même si le résultat est indésirable.
😛
TROP COOL CE SITE 😎
Merchi !
😛
bonjour je voudrais savoir quel est l’effet du CO2 sur le ph des boisson gazeuses
Bonjour,
Le dioxyde de carbone (CO2) n’a pas d’effet sur le pH des boissons gazeuses, ni sur l’eau d’ailleurs.
Si, le co2 porte un effet sur l’acidité des boisson. Il peut fausser les résultats car il devient en présence d’eau un acide carbonique donc il faut degazefier la boisson avant l’analyse.
Oui, tu as raison et mon commentaire précédent était faux. Le dioxyde de carbone augmente bien l’acidité de l’eau et donc de la boisson gazeuse : Influence du dioxyde de carbone sur le pH.